Японски научен пробив в управлението на имунното здраве чрез откритието на код за управление на имунитета – IMMUSE®
Още: Нова идея: Всички ваксинации да бъдат вписани в електронните досиета на пациентите
Още: Чудо преди Великден: Мъж получи шанс за живот след чернодробна трансплантация
Литературен обзор и представяне на продукт за имунна подкрепа – Протектил / Protectill
Автор: Проф. Тодор Кантарджиев
Имунната система е съвкупност от биологични структури и процеси, съхраняващи генетичната уникалност на организма и предпазващи организма от инфекции и собствени мутирали клетки. Имунните механизми са два вида – клетъчни и хуморални. Освен това, при всички гръбначни животни съществуват два вида имунитет - вроден и придобит. Вроденият (или естествен) имунитет е неспецифичен, но се проявява незабавно и в огромната част от случаите е достатъчен за елиминиране на заплахата. Тук основна роля играят фагоцитиращите клетки – макрофаги и неутрофили, естествените клетки убийци (NK клетки), интерфероните и цитокините. Вроденият имунитет включва и бариерните функции на кожата и лигавиците с техните образувания и секрети (мастни жлези, лизозим, подвижни реснички, киселинност и др.) Придобитият (адаптивен) имунен отговор е строго специфичен срещу конкретни носители на чужда генетична информация.
Още: Д-р Аспарух Илиев: Няма голяма опасност от големи епидемии
Още: Ваксинация на бременни срещу опасна за бебета болест: Държавен план
Клетъчната имунна система е описана за първи път от Иля Мечников още през 1883 г. Той доказва съществуването на клетки-фагоцити, в кръвта и тъканите, чиято роля е да идентифицират, улавят и унищожават нахлуващи патогени. Като опитен биолог, той стига до тази идея, наблюдавайки под микроскоп поведението на някои едноклетъчни организми. Фагоцитиращите клетки на човешкото тяло, включително макрофаги и неутрофили, осигуряват бърз отговор на почти всички патогени и инициират възпаление на местата на локална инфекция.
Системата на хуморалния (в течна среда) имунитет, е открита от Паул Ерлих, ученик на Роберт Кох (през 1908 г.заедно с Иля Мечников печелят Нобелова награда, като и двамата не са хематолози). Хуморалният имунен отговор включва производството на циркулиращи антитела, които осигуряват дълготраен системен имунитет, специфичен за антигените, експресирани от даден патоген или от собствени мутирали клетки. Два вида бели кръвни клетки (левкоцити), осъществяват адаптивния имунитет: В-лимфоцитите са отговорни за производството на антитела, а Т-лимфоцитите разпознават и убиват променени клетки на гостоприемника. Различаваме CD8+T лимфоцити, които директно убиват заразените (от вируси или вътреклетъчни бактерии) или мутирали клетки и CD4+ T лимфоцити, които разпознават клетки, погълнали и преработили чужд антигенен материал, инициират всички видове имунни реакции и осигуряват обратното им развитие.
Още: СЗО се готви за нови пандемии
Още: Д-р Алина Десимирова: Натурална формула елиминира усещанията за безпокойство, стрес и “бърнаут“
Освен участието на различни типове клетки, ключовата разлика между вродения и придобития (адаптивен) имунитет са различните начини за разпознаване на чуждата генетична информация: клетките на вродената имунна система са оборудвани да предприемат действия бързо, чрез откриване на биохимични детерминанти, споделяни от широк набор от патогени, но тяхното действие е неспецифично. Клетките на адаптивната имунна система генерират антиген-специфична защита, която отнема повече време за развитие, но е изключително ефикасна. Освен това адативният имунитет притежава уникален компонент - имунната памет, която предпазва прподължително (в някои случаи цял живот) срещу веднъж разпознат патоген.
Отдавна се смята, че вродените и адаптивни рамена на имунната система трябва да бъдат координирани, но едва с откриването на дендритните клетки (DCs) се допълни познанието, за това как имунната система функционира като единна еволюционна единица. Дендритните клетки (DCs) са силно хетерогенна група от циркулиращи в организма клетки, които произхождат от хемопоетичните стволови клетки в костния мозък на човека и са специализирани в улавянето, преработването и представянето на чуждородни антигени на Т-лимфоцитите. Като фагоцитиращи клетки от вродената имунна система, DCs откриват и „поглъщат“ нахлуващите патогени, но вместо да служат за директното унищожаване на патогена, те осъществяват много по-комплициран и утвърден в еволюцията подход. DCs са професионални антиген-представящи клетки, които предават информацията за наличието на патогени на адаптивната имунна система и по този начин инициират трайни, каскадни, антиген-специфични реакции в организма на гостоприемника. През последните петнадесет години е доказано, че освен пептиди (белтъци), DCs имат способността да представят също и гликопептиди на Т-клетките и NKT клетките, както и полипептиди на В-клетките. DCs са отговорни за инициирането на всички антиген-специфични имунни отговори. Те разпознават различни екзогенни и ендогенни антигенни субстанции (бактерии, гъбички, неразтворими частици, увредени или мъртви клетки,включително заразени с вируси, както и клетъчни лизати и др.) чрез неспецифичните си рецептори (лектинови рецептори, PRR - Toll-like рецептори, NOD-like рецептори) и ги фагоцитират. Като такива, те са главния регулатор на имунния отговор и изпълняват тази функция, като свързват, подобно на мост микробните сензорни неспецифични характеристики на вродената имунна система с уникалната специфичност на адаптивния имунен отговор. Благодарение на експресираните от тях МНС-I и MHC-II молекули и ко-стимулиращи рецептори те са изключително ефективни при активирането и на двата типа Т клетки и отключването на правилния тип отговор за даден патоген. За разлика от макрофагите и В клетките, които също представят антигени, но само на вече диференцирани и памтови Т клетки, DC са единствените индуктори на незрелите, наивни Т лимфоцити. Важно е да се отбележи, че DCs не само насочват имунната система да реагира на чуждородни антигени, но същевременно ограничават генерирането на автоимунни реакции, което е жизнено важно за човешкия организъм и запазването на генетичната му уникалност. [i]Това става с участието на регулаторни Т лимфоцити, които се привличат и активират именно от pDC.
Идентифицирането и характеризирането на дендритните клетки предоставя решение на два основни проблема, които дълго време са вълнували имунолозите (Steinman, 1991)[ii]. Преди всичко Steinman идентифицира клетките, необходими за иницииране на Т-клетъчно-зависимите имунни отговори: функция, която никой друг тип клетки не изпълнява толкова ефективно, колкото DCs. Второ, той описва клетка, способна да транспортира и представя в лимфните възли (LN) антигени, уловени в периферните тъкани, като по този начин осигурява клетъчна връзка между вероятните точки на навлизане на патогени и органите, в които се инициират имунни отговори срещу тези патогени. Впоследствие се установява, че DC всъщност са множество подтипове, които се различават по произход, жизнен цикъл и функционални свойства, но споделят достатъчно характеристики, за бъдат включени в едно семейство (Shortman и Naik, 2007 , Villadangos и Schnorrer, 2007)[iii]. Въз основа на генетичните си характеристики, проявен фенотип, функционалност и анатомична локализация, дендритните клетки се раделят основно на две субпопулации: плазмоцитоидни (pDC) и конвенционални или миелоидни (mDC, cDC) дендритни клетки. pDC бяха включени в семейството на DC преди около двадесет години ( Cella et al., 1999 , Grouard et al., 1997 , Siegal et al., 1999 )[iv], но клетките с характеристики на pDCs бяха известни от няколко десетилетия по-рано като „Т-клетъчни асоциирани плазмени клетки”, „плазмоцитоидни Т клетки” и „естествени интерферон-продуциращи клетки” ( Fitzgerald-Bocarsly et al., 2008 г.)[v]. Последното име се отнася до единствената безспорно уникална характеристика на pDCs: тяхната способност бързо да отделят големи количества интерферони тип I (IFN I) в отговор на вирусни инфекции, поради постоянната експресия на транскрипционния фактор IRF-7 ( Fitzgerald-Bocarsly и др., 2008 г. ) [vi]. За да реагират на патогени, pDC не е необходимо да бъдат заразени. Те могат да разпознаят уникалните структурни характеристики на вирусни нуклеинови киселини, като неметилирани богати на CpG ДНК мотиви или двойноверижна РНК, чрез Toll-подобни рецептори (TLR). Когато TLR ангажират тези мотиви, те стартират сигнална каскада, която води до активиране на pDC.
Още: Безплатни консултации с неврохирург - проф. д-р Зафер Токташ
Още: Последното действащо общинско детско отделение в София остава без педиатри
В допълнение към секретирането на IFN I, активираните pDC претърпяват други важни фенотипни промени като придобиването на дендритна морфология и увеличена експресия на МНС-молекули и ко-стимулиращи рецептори за Т клетките. Това позволява на pDC да свързват и активират Т клетки, които се намират в покой ( Asselin-Paturel et al. , 2001 , Bjorck, 2001 , Grouard et al., 1997 , Kadowaki et al., 2001 , Nakano et al., 2001 , O'Keeffe et al., 2002 )[vii][viii][ix][x][xi][xii]. Промените, които претърпяват активираните cDCs, когато открият патогени, се означават като процес на съзряване или диференциация ( Reis e Sousa, 2006)[xiii] Неактивираните и незрели pDCs с кръгла форма и без се означават от някои автори „предварителни pDCs“, запазвайки термина pDCs само за техните активирани двойници ( Shortman и Naik, 2007 , Soumelis и Liu, 2006 ) [xiv][xv]
В заключение pDCs са уникални по 3 специфични начина:
1. Веднъж стимулирани, те бързо секретират повече интерферони, отколкото всяка друга имунна клетка.
2. Считат се за най-ефективните антиген-представящи клетки в имунната система.
3. Те функционират като „лидери“ на имунния отговор, които могат да привлекат и активират почти всички видове имунни клетки
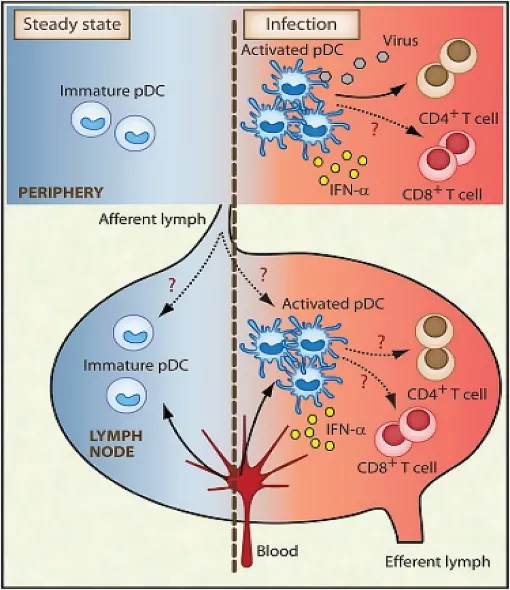
Фигура 1. Миграция и антиген-представящи свойства на pDCs в отсъствие на патология и в условия на инфекция и възпаление [xvi] В отсъствие на патологичен процес (ляво) незрелите pDC циркулират по системата на аферентните и еферентни лимфни съдове между периферната кръв и лимфните възли. В условия на вирусна инфекция (дясно) активираните от вирус pDC се диференцират до професионални антиген-представящи клетки с дендритна морфология, висока експресия на МНС-I и МНС-II молекули и ко-стимулиращи рецептори, които отделят IFN-α и могат да представят антигени както на CD4, така и на CD8-T лимфоцитите.
Като се има предвид централната роля на плазмоцитно дендритните клетки по отношение на правилната и адекватна работа на имунната система, става ясно, че намирането на начин, по който ефективно и безопасно за организма да се стимулират „лидерите на имунната система“, ще представлява нов подход за повлияване на имунното здраве.
Японската компания Kyowa Hakko, част от групата Kirin - една от най-добрите иновативни биохимични компании в света, предоставящи функционални материали с висока добавена стойност и изключително качество за нуждите на фармацевтичните и здравните пазари, си поставя за цел откриването и проучването на нова съставка, която безопасно и ефективно да стимулира pDCs. След тестване на повече от сто различни щама млечнокисели бактерии, те откриват един щам LC-Plasma, който директно активира pDCs. Култивиран с помощта на патентована технология на Kirin, уникалният щам е термично обработен, което го прави нежизнеспособен, по-лесен за съхранение и оптимално ефективен. Този инактивиран щам, който задейства само целевите отговори чрез специфични взаимодействия с рецепторите на LC-Plasma, е наречен IMMUSE® - нов парабиотик за проактивна имунна подкрепа, със специфичен механизъм на действие, а именно – активиране на pDCs- клетките лидери в имунната система.[xvii][xviii]
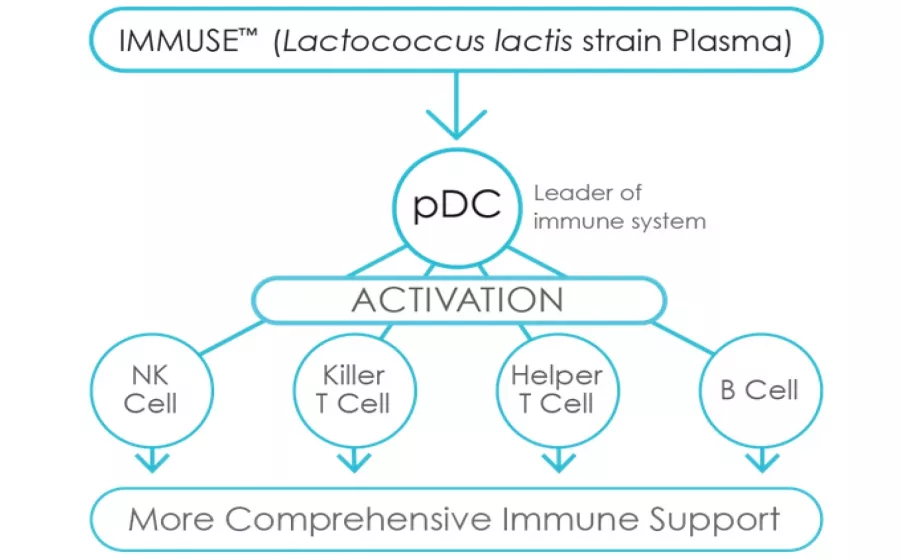
Фиг. 2. Как IMMUSE® действа на точното място при имунния отговор? LC-Plasma въздейства на pDC, които от своя страна като „лидери“ на имуния отговор активират всички клетъчни ефектори на имунния отговор: NK клетките, цитотоксичните CD8 T , хелперните CD4 T и В- лимфоцитите. Резултатът е една по-цялостна подкрепа за имунната система.
Купи онлайн ПРОТЕКТИЛ с IMMUSE® с -15% - ТУК!
Научно доказано е, че в Пайеровите плаки – лимфоидни структури, намиращи се в тънките черва, се намират значителна част от имунните клетки ( включително и pDC). При перорален прием, IMMUSE® преминава през стомашно-чревния тракт, където специализираните М-клетки в чревната лигавица го транспортират до Пайеровите плаки. Там IMMUSE® стимулира различни видове имунни клетки, което води до укрепване на цялостната имунна защита.
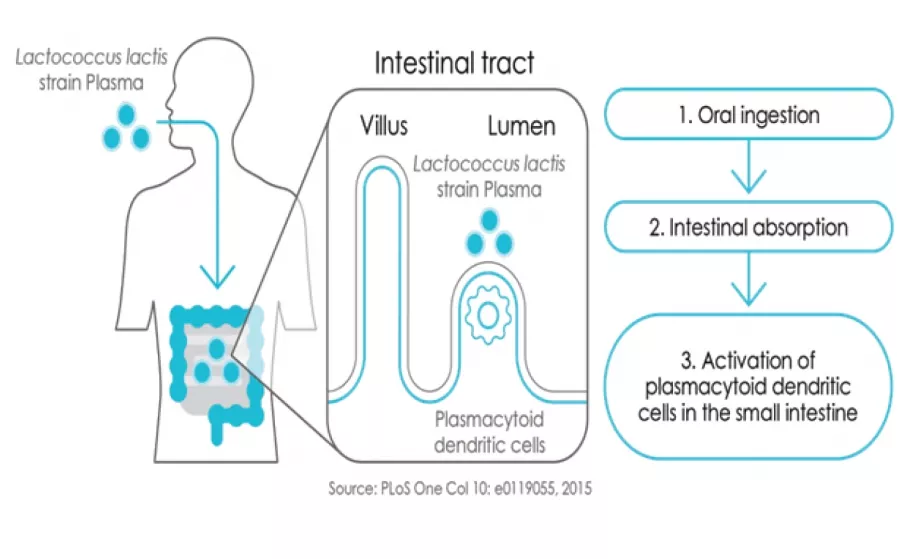
Фиг.3. Представяне на LC-Plasma 1. Перорален прием 2. Абсорбция в чревната лигавица. 3. Активиране на плазмоциотоидните дендритни клетки в лигавицата на тънкото черво
Проучванията при хора (публикувани са 15 до момента) показват, че IMMUSE® безопасно стимулира защитната система на човешкия организъм на клетъчно ниво. Клиничните проучвания потвърждават също така неговата ефикасност и безопасност и дават доказателства, че осигурява имунна подкрепа за здрава и силна имунна система.[xix] При експериментални миши и човешки модели in vitro е доказано, че LC-Plasma индуцира производството на интерферон-α (IFN-α) и предотвратява вирусна инфекция.
В допълнение, пероралното приложение на LC-Plasma при мишки значително потиска възпалението на белите дробове и предотвратява смъртния изход от парагрипна вирусна инфекция чрез повишаване на белодробния антивирусен имунитет
От 15 клинични проучвания до момента, 13 проучвания за ефикасност потвърждават положителното въздействие на IMMUSE® върху имунното здраве. Доказано е, че IMMUSE® помага за поддържане на здравето през зимния сезон, както и за подобряването му през цялата година, когато се приема редовно но, разбира се, с прекъсвания.
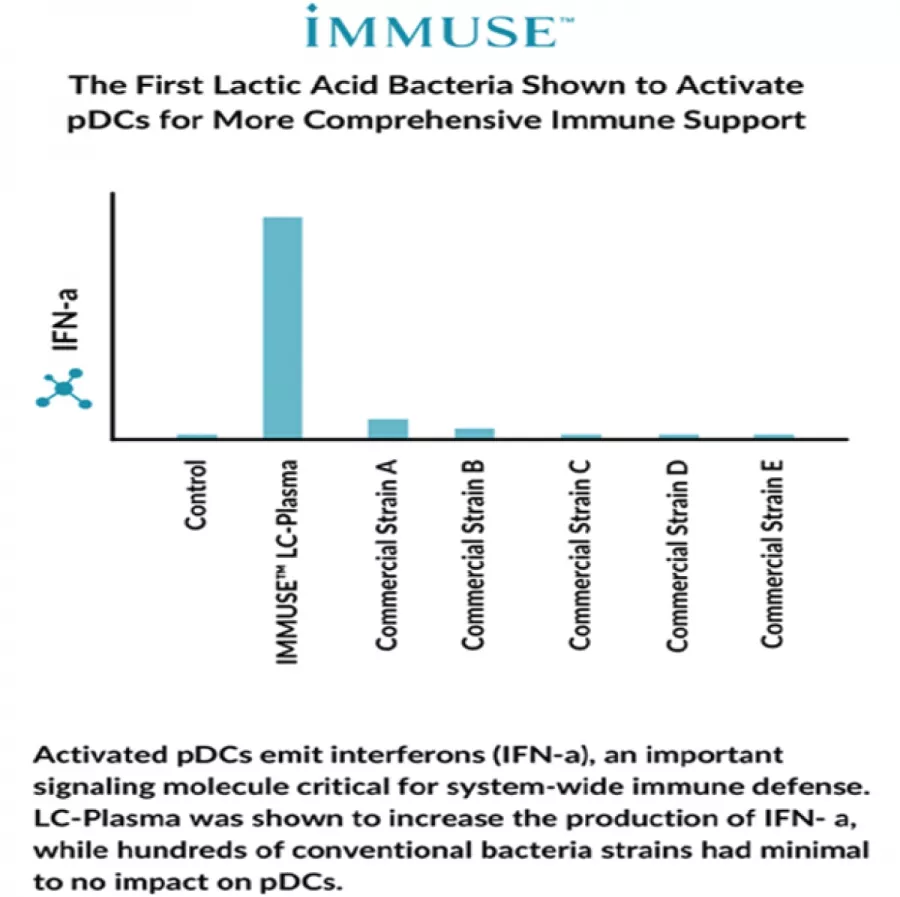
Фиг. 4: Активиране на pDC от различни бактериални щамове, сравнено по продукцията на интерферон-алфа. (данни на Kyowa Hakko) Активираните pDC отделят интерферон-алфа, сигнална молекула с критична роля в системния имунен отговор. LC-plasma повишава образуването на интерферон-алфа, за разлика от стотици конвенционални бактериални щамове с минимален или липсващ ефект върху pDC.
IMMUSE® има напълно нов и научно обоснован механизъм на въздействие върху имунитета, благодарение на разгадаването на ролята на pDC. Това го отличава от повечето известни досега продукти за имунно здраве .[xx]
Белгийската фармацевтична група Ceres Pharma, чрез своето подразделение Абофарма - България вече предлага на българския пазар от началото на 2023 г. комплексна формула за подкрепа на имунната система, а именно – продуктът Протектил, който съдържа новата японска разработка IMMUSE® в комбинация с арабиногалактан, бета глюкани, ехинацея, коластра и цинк.
Както е известно арабиногалактанът повишава потенциала на човешкия организъм за защита срещу инфекции, като увеличава значително защитните антитела, включително IgG, активира естествените клетки-убийци и макрофагите, както и секрецията на противовъзпалителни цитокини.
Бета- глюканите активират макрофагите, NK клетките и неутрофилите и имат доказана роля в имунната защита. Факт, известен от десетилетия.
Ехинацеята повишава вродения имунитет и засилва способността на имунната система да се бори с патогенните инфекции чрез активиране на неутрофили, макрофаги, и NK клетки.
Коластрата съдържа високи концентрации на всички пет класа имуноглобулини (IgG, IgD, IgA, IgM ,IgE ), необходими на човешкия организъм за адекватен имунен отговор срещу патогени от различен произход.
Цинкът регулира адекватно производството на цитокини, активира Т- лимфоцитите и има централна роля за осъществяване на имунния отговор.
Купи онлайн ПРОТЕКТИЛ с IMMUSE® с -15% - ТУК!
Протектил e комплекс от иновативни и традиционни съставки за ефективна работа на имунната система – следващо поколение имунна защита.
Протектил управлява имунната система, като и помага да реагира бързо , ефективно и адекватно при среща с патогени.
Протектил се препоръчва за деца над 8 години и възрастни, като осигурява клинично изследвана имунна подкрепа, проактивно поддържа имунната система и стимулира естествените защитни сили на организма на клетъчно ниво.
За поддържане на имунитета в добра кондиция се препоръчва употребата на Протектил до два пъти в годината в курс от 3 месеца през рисковите периоди.
Литературна справка:
[i] Ira Mellman, 2013, Dendritic Cells: Master Regulators of the Immune Response
[iii] Ken Shortman 1, Shalin H Naik, 2007 Jan. Steady-state and inflammatory dendritic-cell development
G Grouard 1, M C Rissoan, L Filgueira, I Durand, J Banchereau, Y J Liu, Exp Med,1997 Mar The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand
F P Siegal 1, N Kadowaki, M Shodell, P A Fitzgerald-Bocarsly, K Shah, S Ho, S Antonenko, Y J Liu, 1999 Jun 11, The nature of the principal type 1 interferon-producing cells in human blood
[ii] Steinman RM, 1991, The dendritic cell system and its role in immunogenicity.
[iv] M. Cella, D. Jarrossay, F. Facchetti, O. Alebardi, H. Nakajima, A. Lanzavecchia, M. ColonnaNat. Med., 5 (1999), Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon
[v] P. Fitzgerald-Bocarsly, J. Dai, S. Singh, 2008, Plasmacytoid dendritic cells and type I IFN: 50 years of convergent histor
[vi] P. Fitzgerald-Bocarsly, J. Dai, S. Singh, 2008, Plasmacytoid dendritic cells and type I IFN: 50 years of convergent histor,
[vii] C. Asselin-Paturel, A. Boonstra, M. Dalod, I. Durand, N. Yessaad, C. Dezutter Dambuyant, A. Vicari, A. O'Garra, C. Biron, F. Briere, G. Trinchieri, 2001, Mouse type I IFN-producing cells are immature APCs with plasmacytoid morphology
P. Bjorck, 2001, Isolation and characterization of plasmacytoid dendritic cells from Flt3 ligand and granulocyte-macrophage colony-stimulating factor- treated mice
G. Grouard, M.C. Rissoan, L. Filgueira, I. Durand, J. Banchereau, Y.J. Liu, 1997, The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand
N. Kadowaki, S. Ho, S. Antonenko, R. de Waal Malefyt, R.A. Kastelein, F. Bazan, Y.J. Liu, 2001, Subsets of human dendritic cell precursors express different toll-like receptors and respond to different microbial antigens
H. Nakano, M. Yanagita, M.D. Gunn, 2001, CD11c(+)B220(+)Gr-1(+) cells in mouse lymph nodes and spleen display characteristics of plasmacytoid dendritic cells
M. O'Keeffe, H. Hochrein, D. Vremec, I. Caminschi, J.L. Miller, E.M. Anders, L. Wu, M. Lahoud, S. Henri, B. Scott, et al,, 2002, Mouse plasmacytoid cells: Long-lived cells, heterogeneous in surface phenotype and function, that differentiate into CD8+ dendritic cells only after microbial stimulus
C. Reis e Sousa, 2006, Dendritic cells in a mature age
K. Shortman, S.H. Naik, 2007, Steady-state and inflammatory dendritic-cell development
V. Soumelis, Y.J. Liu, 2006, From plasmacytoid to dendritic cell: Morphological and functional switches during plasmacytoid pre-dendritic cell differentiation
José A.Villadangos1LouiseYoung,, 2008, Antigen-Presentation Properties of Plasmacytoid Dendritic Cells
Sugimura T, Jounai K, Ohshio K, Tanaka T, Suwa M, and Fujiwara D., 2013. Immunomodulatory effect of Lactococcus lactis JCM5805 on human plasmacytoid dendritic cells.
[xviii] Lactococcus lactis subsp. lactis JCM5805 activates Natural Killer Cells via Dendritic cells.
Suzuki H, Ohshio K, Fujiwara D., 2016
[xix] The safety evaluation of long‒term or excessive intake of the beverage containing Lactococcus lactis subsp. lactis JCM 5805 and resistant maltodextrin -a randomized, double‒blind, placebo‒controlled, parallel‒group trial.
Tanaka K, Suzuki H, Kanayama M, Fujii T, Fujiwara D, Nozawa H, Sugimura K., 2015
Публикации свързани с проучване на IMMUSE®:
1. Jounai K, Ikado K, Sugimura T, Ano Y, Braun J, Fujiwara D. (2012) Spherical lactic acid bacteria activate plasmacytoid dendritic cells immunomodulatory function via TLR9-dependent crosstalk with myeloid dendritic cells. PLoS One 7: e32588.
2. Sugimura T, Jounai K, Ohshio K, Tanaka T, Suwa M, Fujiwara D. (2013) Immunomodulatory effect of Lactococcus lactis JCM5805 on human plasmacytoid dendritic cells. Clin Immunol 149: 509–518.
3. Jounai K, Sugimura T, Ohshio K, Fujiwara D. (2015) Oral administration of Lactococcus lactis subsp. lactis JCM5805 enhances lung immune response resulting in protection from murine parainfluenza virus infection. PLoS One. 6: e0119055.
4. Fujii T, Tomita Y, Ikushima S, Horie A, Fujiwara D. (2015) Draft genome sequence of Lactococcus lactis subsp. lactis JCM 5805T, a strain that induces plasmacytoid dendritic cell activation. Genome Announc 3 : e00113-15
5. Sugimura T, Takahashi H, Jounai K, Ohshio K, Kanayama M, Tazumi K, Tanihata Y, Miura Y, Fujiwara D, Yamamoto N. (2015) Effects of oral intake of plasmacytoid dendritic cells-stimulative lactic acid bacterial strain on pathogenesis of influenza-like illness and immunological response to influenza virus. Br J Nutr. 3:1-7.
6. Suzuki H, Kanayama M, Fujii T, Fujiwara D, Sugimura K2015Effects of the beverage containing Lactococcus lactis subsp. lactis JCM5805 on anti_viral immune responses and maintenance of physical conditions -a randomized, double_blind, placebo_controlled, parallel_group TrialJpn Pharmacol Ther. 43:1465_72.
7. Tanaka K, Suzuki H, Kanayama M, Fujii T, Fujiwara D, Nozawa H, Sugimura K.(2015) The safety evaluation of long_term or excessive intake of the beverage containing Lactococcus lactis subsp. lactis JCM 5805 and resistant maltodextrin -a randomized, double_blind, placebo_controlled, parallel_group trialJpn Pharmacol Ther. 43:1711_27.
8. Suzuki H, Ohshio K, Fujiwara D. (2016) Lactococcus lactis subsp. lactis JCM5805 activates natural killer cells via dendritic cells. Biosci Biotec Biochem. 80: 798-800.
9. Shibata T, Kanayama M, Haida M, Fujimoto S, Oroguchi T, Sata K, Mita N, Kutsuzawa T, Ikeuchi M, Kondo M, Naito K, Tsuda M, Nishizaki Y, Ishii N. (2016) Lactococcus lactis JCM5805 activates anti-viral immunity and reduces symptoms of common cold and influenza in healthy adults in a randomized controlled trial. J Func Food. 24: 492-500.
10. Sakata K, Sasaki Y, Jounai K, Fujii T, Fujiwara D. (2017) Preventive effect of Lactococcus lactis subsp. lactis JCM 5805 yogurt intake on influenza infection among schoolchildren. Health 9: 756-762.
11. Fujii T,Jounai K, Horie A, Takahashi H, Suzuki H, Oshio K, Fujiwara D, Yamamoto N. (2017) Effects of heat-killed Lactococcus lactis subsp. lactis JCM 5805 on mucosal and systemic immune parameters, and antiviral reactions to influenza virus in healthy adults; A randomized controlled double-blind study. J Func Food. 35: 513-521.
12. Jounai K, Sugimura T, Morita Y, Ohsio K, Fujiwara D. (2018) Administration of Lactococcus lactis strain Plasma induces maturation of plasmacytoid dendritic cells and protection from rotavirus infection in suckling mice. Int Immunopharmacol., 56: 205-211.
13. Kanayama M, Kato Y, Tsuji T, Konoeda Y, Hashimoto A, Kanauchi O, Fujii T, Fujiwara D.
(2018) Enhancement of immunomodulative effect of lactic acid bacteria on plasmacytoid dendritic cells with sucrose palmitate. Sci Rep., 8: 3147.
14. Sugimura T, Jounai K, Ohshio K, Suzuki H, Kirisako T, Sugihara Y, Fujiwara D. (2018) Long-term administration of pDC-stimulative Lactococcus lactis strain decelerates senescence and prolongs the lifespan of mice. Int Immunopharmacol., 58:166-172.
15. Tsuji R, Komano Y, Ohshio K, Ishii N, Kanauchi O. (2018) Long-term administration of pDC stimulative lactic acid bacteria, Lactococcus lactis strain Plasma, prevents immune-senescence and decelerates individual senescence. Exp Gerontol., 111: 10-16.
16. Suzuki H, Jounai K, Ohshio K, Fujii T, Fujiwara D. (2018) Administration of plasmacytoid dendritic cell-stimulative lactic acid bacteria enhances antigen-specific immune responses. Biochem Biophys Res Commun., 503: 1315-1321.
17. Kato Y, Kanayama M, Yanai S, Nozawa H, Kanauchi O, Suzuki S. (2018) Safety evaluation of excessive intake of Lactococcus lactis subsp. lactis JCM 5805: A randomized, double-blind, placebo-controlled, parallel-group trial. Food Nutr Sci., 9:403-419.
18. Komano Y, Shimada K, Naito H, Fukao K, Ishihara Y, Fujii T, Kokubo T, Daida H. (2018) Efficacy of heat-killed Lactococcus lactis JCM 5805 on immunity and fatigue during consecutive high intensity exercise in male athletes: a randomized, placebo-controlled, double-blinded trial. J Int Soc Sports Nutr., 15:39.
19. Suzuki H, Tsuji R, Sugamata M, Yamamoto N, Yamamoto N, Kanauchi O. (2019) Administration of plasmacytoid dendritic cell stimulative lactic acid bacteria is effective against dengue virus infection in mice. Int J Mol Med., 43:426-434.
20. Tsuji R, Yamamoto N, Yamada S, Fujii T, Yamamoto N, Kanauchi O. (2018) Induction of anti-viral genes mediated by humoral factors upon stimulation with Lactococcus lactis strain Plasma results in repression of dengue virus replication in vitro. Antiviral Res., 160:101-108.
21. Kokubo T, Komano Y, Tsuji R, Fujiwara D, Fujii T and Kanauchi O. (2019) Plasmacytoid dendritic cell-stimulative lactic acid bacteria, Lactococcus lactis strain Plasma, relieves exercise-induced fatigue and aids recovery via immuno-modulatory action. Int J Sport
Nutr Exer Metabol., 5:1-5, 2019.
22. Horie A, Tomita Y, Oshio K, Fujiwara D, Fujii T. (2019) Characterization of genomic DNA of lactic acid bacteria for activation of plasmacytoid dendritic cells. BMC Microbiol., 19: 88, 2019.
23. Tsuji R, Fujii T, Nakamura Y, Yazawa K, Kanauchi O. (2019) Staphylococcus aureus epicutaneous infection is suppressed by Lactococcus lactis strain Plasma via IL-17A elicitation. J Infect Dis., Jul 31;220(5):892-901 2019.
24. Sugimura T, Jounai K, Ohshio K, Fujiwara D. (2019) Plasmacytoid dendritic cell dysfunction caused by heat stress is improved by administration of Lactococcus lactis strain Plasma in mice. Biosci Biotec Biochem. ,Jul 18:1-4. 2019.
25. Takeshi Kokubo, Shimpei Wakai, Daisuke Fujiwara, Osamu Kanauchi, Kenta Jounai, Hisahiro Ichikawa, Mihoko Takuma, Yoshihisa Kanaya, and Ryohei Shiraoka (2020) Lactococcus-lactis-Strain-Plasma-Improves-Subjective-Physical-State-and-Presenteeis m-A Randomized-Open-Label-Crossover-Study-among-Healthy-Office-Workers Prev. Nutr. Food Sci. 2020;25(2):140-145
26. Tsuji R, Yazawa K, Kokubo T, Nakamura Y, Kanauchi O. The Effects of Dietary Supplementation of Lactococcus lactis Strain Plasma on Skin Microbiome and Skin Conditions in Healthy Subjects—A Randomized, Double-Blind, Placebo-Controlled Trial. Microorganisms. 2021; 9(3):563.